Jak jsme již uvedli výše, voda na zemském povrchu je součástí hydrosféry. Její množství je téměř konstantní, mění se jen její skupenství. Molekuly vody mohou zůstat v jedné formě během velmi dlouhého časového období a v jiných formách jen krátkou dobu.
Koloběh vody na Zemi je zajišťován různými procesy:
sublimace– změna skupenství pevné látky přímo na plyn (plynné skupenství) bez
předchozího tání
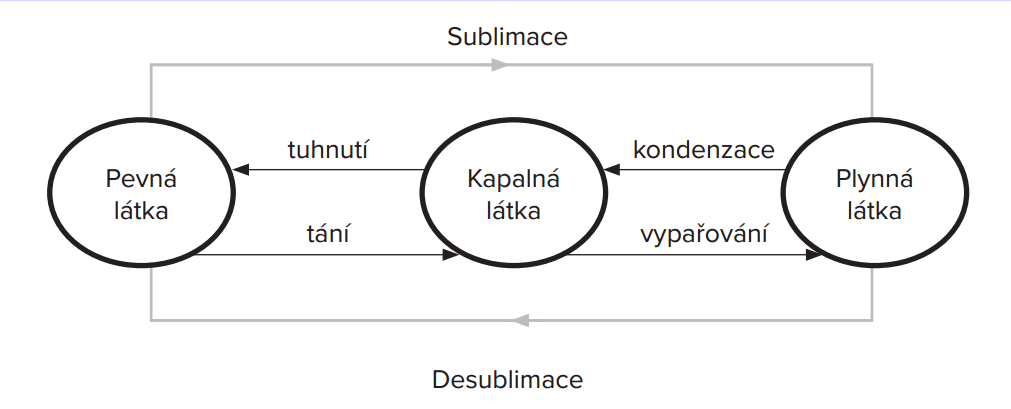
Hmota se může vyskytovat v 3 skupenstvích - plynném, kapalném a pevném.
Pevná látka má neměnný tvar a objem. Pevné látky se dělí na krystalické a amorfní látky. Typickým znakem pro krystalické látky je pravidelné uspořádání částic (např. diamant, sůl, různé kovy – měď, zinek, olovo atd.). Naopak, amorfní látky nemají pravidelné uspo řádání částic (např. sklo, vosk). Kapalné a plynné látky mohou volně „téct“ a přizpůsobit se tvaru nádoby. Změna skupenství obvykle nastává změnou teploty, t. j. ochlazením a ohříváním. V literatuře se můžeme setkat i s tzv. čtvrtým skupenstvím, které se označuje plazma. Jde o ionizovaný plyn, který je složen z iontů a elektronů (případně z neutrálních atomů a molekul). Nemá pevný tvar a je schopna vést elektrický proud a reagovat na mag netické pole.
Při změně skupenství hmoty z jednoho na jiné mluvíme o fázové přeměně. Fázovou pře měnou se vždy mění i některé vlastnosti látek, jako např. objem, hustota, tepelná vodivost atd.
Tání– při zahřívání tělesa, které je z krystalické látky (např. led, kov) se zvyšuje jeho teplota. Pokud teplota dosáhne určitou teplotu, zvanou teplota tání (odlišná pro různé krystalické látky), dochází ke změně skupenství – z pevného na kapalné. Teplota tání krystalické látky závisí na vnějším tlaku. Při zahřívání amorfní látky, látky postupně měknou a postupně se promění na kapalinu. Na rozdíl od krystalických látek nemají určitou teplotu tání. Například dřevo nelze zahřát na teplotu tání – dochází k jejich rozkladu. Teplota tání se snižuje rozpuštěním soli, což známe např. ze zimního období. Když posypeme zamrzlý chodník solí, sníží se jeho teplota tání a led roztaje. Při tání dochází u většiny látek ke zvětšení jejich objemu. Výjimkou je např. led, který při tání svůj objem zmenšuje a naopak při tuhnutí zvětšuje.
Tuhnutí – při ochlazování kapaliny, která vznikla táním krystalické látky, dochází při teplotě tuhnutí k její změně, t. j. mění se na pevnou látku. Avšak pevné skupenství nevzniká okamžitě. Když dosáhne kapalina teploty tuhnutí, postupně se v ní začnou vytvářet tzv. kondenzační jádra, ke kterým se postupně připojují a pravidelně uspořá dávají další částice. Při tuhnutí dochází u většiny látek ke zmenšení jejich objemu.
Sublimace– jde o přeměnu pevné látky na plynnou látku, např. jód, kafr, suchý led, bez přechodu přes kapalné skupenství.
Desublimace – je opačný proces než sublimace. Jde tedy o přeměnu látky z plynného skupenství na pevné skupenství. Plyn se mění přímo na pevnou látku bez konden zace.
Vypařování – přeměna kapalné látky na plynnou, která probíhá na povrchu kapalné látky za každé teploty, při níž kapalné skupenství existuje. Rychlost vypařování závisí na druhu kapaliny (nejrychleji se například vypařuje éter), na teplotě (se zvyšující se teplotou se zvyšuje i rychlost vypařování) a na velikosti obsahu povrchu hladiny. Se zvyšující se teplotou se zvyšuje i rychlost vypařování.
Kondenzace – opačný děj než vypařování, t. j. změna plynného skupenství na kapalné. Tato změna nastává např. při snížení teploty.