Vzduch okolo nás
Atmosféra
Naši Zem obklopuje mohutná vrstva vzduchu zvaná atmosféra, dosahující do výšky několika tisíc kilometrů nad zemským povrchem. Složení atmosféry závisí na výšce nad zem ským povrchem.Pro náš život je důležitá nejnižší vrstva atmosféry zvaná troposféra, která zasahuje zhruba do výšky 7 km nad zemským povrchem, důležité je její složení. Troposféra je nejhustější část atmosféry.S narůstající výškou nad zemským povrchem hustota atmosféry klesá. Hustota suchého vzduchu u povrchu země a při 20 °C je 1,2047, což odpovídá hmotnosti 1,2 g na jeden litr vzduchu. Působením tahové síly Země jsou veškeré částice atmosféry stále přitahovány k jejímu povrchu, čímž je celá atmosféra připoutána k Zemi. Výsledkem tohoto působení je atmosférická tlaková síla.
Atmosférická tlaková síla
Atmosférická tlaková síla působí na celý povrch Země a na všechna pozemská tělesa, tedy i na nás.Pokud se atmosférická tlaková síla zmenší, dojde k rozpínání pružných těles, která obsahují plyn. Když se naopak atmosférická tlaková síla zvětší, dojde k deformaci a zmenšení objemu pružných těles, která obsahují plyn. Tento jev můžeme demonstrovat injekční stříkačkou, do které vložíme bonbón typu marshmallow (Obrázek 6). Injekční stříkačku uzavřeme pístem, který necháme v horní poloze a její ústí uzavřeme palcem. Při stlačení pístu vzniká uvnitř injekční stříkačky vyšší tlak, než je tlak atmosférický a dochází k tlakové deformaci bonbónu a zmenšení jeho objemu.
Ukázka vlivu nižšího tlaku je obdobná. Injekční stříkačku uzavřeme pístem, který posuneme co nejblíže k bonbónu, ale tak, aby nedošlo k jeho deformaci. Ústí uzavřeme palcem. Při tažení pístu vzniká uvnitř injekční stříkačky nižší tlak (podtlak) než je tlak atmosférický a dochází k rozpínání plynu uvnitř bonbónu a tím ke zvětšení jeho objemu. Troposfé ra obsahuje přibližně 78 % dusíku (N2), 21 % kyslíku (O2), 0,9 % argonu (Ar), 0,03 % oxidu uhličitého (CO2) a další plyny.
Kyslík
Kyslík(chemická značka O, latinský název Oxygenium) je plynný prvek, který tvoří druhou největší část zemské atmosféry. Kyslík je bezbarvý plyn bez chuti a bez zápachu, který vzniká jako koncový produkt fotosyntézy rostlin. Ve vzduchu se kyslík vyskytuje jako dvouatomová molekula O2, nebo jako tříatomová molekula O3, která je označována jako ozón. Kyslík je biogenní prvek, jehož přítomnost je nutná pro existenci většiny živých organizmů na naší planetě. Kyslík se rozpouští ve vodě a působí jako silné oxidační činidlo.
V 15. století Leonardo da Vinci studoval vlastnosti vzduchu a zjistil, že jedna z jeho složek podporuje hoření. My dnes víme, že jde o kyslík. Poprvé kyslík objevil v roce 1772 Carl Wilhelm Sheele a pojmenoval ho „ohnivý vzduch“.Svůj objev však hned nepublikoval, a tak je objevení a dokázání kyslíku přisuzováno Josephovi Priestleymu, který ho objevil až o dva roky později – v roce 1774 a v tom stejném roce svůj objev publikoval.
Kyslík a hoření (pokus)
Nutnost kyslíku pro hoření, a tím i samotný důkaz kyslíku vykonáme jednoduchým pokusem. Budeme potřebovat kádinku nebo sklenici, čajovou svíčku, zápalky, misku nebo talíř a vodu z vodovodu. Talíř naplníme vodou a položíme do něj zapálenou svíčku. Parafín, z něhož je svíčka vyrobena, má menší hustotu než voda, proto když ji opatrně položíme na hladinu vody, svíčka se nepotopí. Po přiklopení svíčky kádinkounebo sklenicí uvidíme, že hladina vody uvnitř kádinky je níže, než je volná hladina vody v talíři. Plamen svíčky ohřívá vzduch uvnitř kádinky a ten se rozpíná. Můžeme pozorovat, že z kádinky unikají bubliny vzduchu. Při hoření parafínu dochází ke spotřebě kyslíku, který byl obsažen v kádince. Jakmile je všechen kyslík spotřebován, plamen zhasne. Zároveň dojde k ochlazení ohřátého vzduchu. Studený vzduch má větší hustotu než vzduch teplý, a proto se začne zmenšovat jeho objem, a tím dojde k nasání vody z talíře do kádinky. Na konci pokusu je hladina vody v kádince nad úrovní volné hladiny vody v talíři. Zamezení přístupu kyslíku k hořícím předmětům se využívá při hašení požárů.
Oxid uhličitý
Oxid uhličitý (chemická značka CO2 ) je plynná molekula, která vznikne sloučením jed noho atomu uhlíku a dvou atomů kyslíku. Oxid uhličitý je bezbarvý plyn bez chuti a bez zápachu.Vzniká jako koncový produkt dýchání živočichů. Do atmosféry se taktéž dostává jako plyn, který vzniká spalováním uhlí, dřeva a dalších organických látek a při kvašení.
Oxid uhličitý je nehořlavý plyn a má větší hustotu než vzduch, proto zůstává u země. Této vlastnosti oxidu uhličitého jsou si dobře vědomi výrobci vína. Vinaři v místnosti, ve které kvasí víno, a to např. při výrobě burčáku, mají zapálenou svíčku, kterou umístí do menší výšky, než ve které dýchají. Jakmile svíčka zhasne, upozorní je, že koncentrace oxidu uhličitého je příliš vysoká a že musí místnost opustit, jinak by se udusili.
V laboratoři se většinou připravuje reakcí uhličitanů s kyselinou chlorovodíkovou (reakční schéma 1) nebo reakcí jedlé sody s octem (reakční schéma 2) v aparatuře na vývoj plynu (Obrázek 1).
Reakční schéma 1: Reakce uhličitanu vápenatého s kyselinou chlorovodíkovou
CaCO3 + 2 HCl → CaCl 2+ H2O + CO2
Reakční schéma 2:Reakce jedlé sody (hydrogenuhličitan sodný) s octem (kyselinou octovou)
NaHCO3 + CH3 COOH → CH3 COONa + H2O + CO2
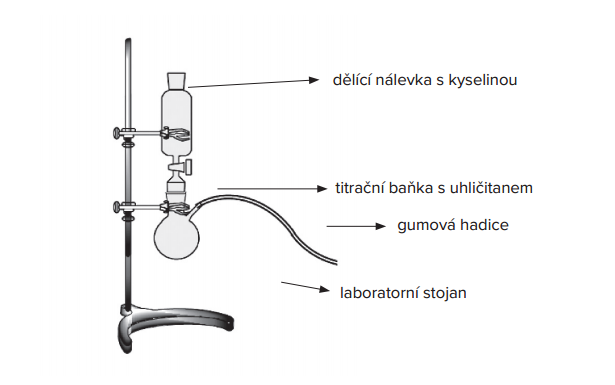
Obrázek 1: Aparatura na vývoj plynu
(zdroj: http://chemicke-pokusy-pro-gymnazia.webnode.cz/priprava-kysliku-a-vodiku/)
Nehořlavost oxidu uhličitého a jeho větší hustotu, než má vzduch si dokážeme jednoduchým pokusem se čtyřmi různě vysokými hořícími svíčkami. Svíčky umístíme do pneumatické vany a z aparatury na vývoj plynu (Obr. 2) k nim budeme přivádět oxid uhličitý. Svíčka, která je nejníže, zhasne jako první. Svíčka, která je nejdelší, bude hořet nejdéle.
Nehořlavé vlastnosti oxidu uhličitého jsou využívány při hašení požárů.Oxid uhličitý je hasicí médium ve sněhových hasicích přístrojích. Tyto hasicí přístroje mohou být použity jen v dobře větraných místnostech. Oxid uhličitý se dokazuje reakcí s vápennou vodou. Vápenná voda je čirá suspenze hydroxidu vápenatého jemně rozptýleného ve vodě. Při probublání vápenné vody oxidem uhličitým vzniká bílá sraženina uhličitanu vápenatého (reakční schéma 3).
Reakční schéma 3:Reakce vápenné vody s oxidem uhličitým
Ca(OH)2 + CO2 → CaCO3 + H2O
Ve vydechovaném vzduchu se snižuje obsah kyslíku z 21 % zhruba na 17 % a vzrůstá obsah oxidu uhličitého z 0,03 % až na 4 %. Dále se zvětšuje koncentrace vodní páry ve vydechovaném vzduchu. Vodní páru je možné dokázat dýchnutím na studený předmět, např. na kapesní zrcátko nebo skleničku. Množství dusíku ve vydechovaném vzduchu zůstává zachováno. Oxid uhličitý je možné ve vydechovaném vzduchu dokázat vápennou vodou (reakční schéma 3).



